
Джохадзе Лела Сергеевна, к.м.н., доцент кафедры акушерства и гинекологии лечебного факультета ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России
Холистический подход в медицине (от древнегреческого слова «целостный»), предполагает рассмотрение пациента как единой системы с учетом его физического, эмоционального и социального состояния.
Такой подход демонстрирует лучшие клинические результаты по сравнению с узконаправленной терапией отдельных симптомов. Особую актуальность он приобретает при железодефицитных состояниях – латентном дефиците железа (ЛДЖ) и железодефицитной анемии (ЖДА), которые длительное время могут протекать бессимптомно, представляя скрытую угрозу здоровью. Сегодня в мире ЛДЖ имеет более 1.5 млрд человек [1].Недостаток железа с последующим развитием ЛДЖ и ЖДА может быть связан с недостаточным поступлением железа с пищей, нарушением его всасывания и транспортировки, а также избыточными потерями или повышенными потребностями в железе. Исследования и клиническая практика показывают: железодефицитные состояния проявляются не только «традиционными» симптомами, но и комплексом неспецифических нарушений, включая когнитивные расстройства, снижение качества обучения, устойчивости к инфекциям (у пациентов с ЛДЖ и ЖДА отмечаются частые ОРВИ и рецидивирование хронических заболеваний) и толерантности к физической нагрузке.
Многочисленные исследования демонстрируют устойчивую связь между железодефицитом и нарушениями фертильности, включая ухудшение сперматогенеза у мужчин и нарушение развития фолликулов у женщин.
Дефицит железа у беременных ассоциирован с повышенным риском задержки роста и дистресса плода, низкого веса при рождении и преждевременных родов. Отдаленные последствия для детей включают дефицит железа, нарушения памяти, восприятия информации и снижение интеллектуальных способностей [2-5].Клиническая картина железодефицитных состояний представлена двумя синдромами – анемическим и сидеропеническим. Анемический синдром проявляется слабостью, головной болью, одышкой, тахикардией и снижением когнитивных функций. Сидеропенический синдром характеризуется широким спектром патофизиологических нарушений, включая изменениями кожи и ее придатков, мышечную слабость, извращение вкуса и нейропсихиатрические нарушения. Наиболее видимыми маркерами сидеропенического синдрома являются изменения кожных покровов, проявляющиеся бледной пигментацией и повышенной сухостью, а также дистрофические изменения слизистых оболочек. Одновременно могут наблюдаться трофические нарушения придатков кожи: ногти становятся ломкими и исчерченными, волосы – тусклыми и склонными к выпадению. Помимо дерматологических проявлений, сидеропенический синдром характеризуется разнообразными системными нарушениями. Со стороны сердечно-сосудистой системы это может быть артериальная гипотония, сопровождающаяся мышечной слабостью и в некоторых случаях – недержанием мочи при напряжении. Неврологические нарушения могут проявляться в виде синдрома беспокойных ног и изменения обоняния и вкуса, которые часто предшествуют развитию явной анемии. Характерным и высокоспецифичным (95%) проявлением железодефицита у женщин является пагофагия – извращение вкуса с тягой к употреблению несъедобных веществ. Этот признак, наряду с затрудненным глотанием, покраснением языка и заедами в углах рта, составляет типичную картину сидеропенического синдрома. У 10-15% здоровых людей может также наблюдаться битурия – изменение цвета мочи после употребления свеклы, что также может служить дополнительным диагностическим маркером железодефицита. Со стороны иммунной системы при железодефицитных состояниях наблюдается снижение резистентности организма к инфекциям, проявляющееся частыми ОРВИ, обострениями герпетической инфекции и медленным заживлением ран. Длительно сохраняющаяся субфебрильная температура и стойкое снижение аппетита – наиболее тревожные неспецифические симптомы, которые часто заставляют заподозрить серьезное соматическое заболевание. Наконец, ЛДЖ нередко сопровождается психоэмоциональными нарушениями (депрессия, эмоциональное выгорание и повышенная чувствительность к холоду), которые могут быть первыми и основными жалобами пациента [6–8].
Современные эпидемиологические исследования демонстрируют высокую распространенность и диагностические сложности при выявлении ЛЖД. В Швейцарии, где дефицит железа имеется у каждой десятой женщины, большинство (96%) пациенток с верифицированным в течение последних 2 лет диагнозом ЛЖД (1010 женщин в возрасте 18-50 лет, средний возраст 33.5 года) предъявляли жалобы на усталость и общее недомогание, а 41% отмечали выраженное снижение энергии. Особенно тревожит тот факт, что треть (35%) обследованных изначально получили ошибочный диагноз, а почти половина (47%) – неадекватное лечение (Таблица 1). Социально-экономические последствия ЛЖД также неутешительны: каждая третья (28.5%) женщина была вынуждена оформлять больничные листы из-за симптомов, связанных с дефицитом железа ([9].
Таблица 1. О чем «врет» железодефицит? Частота ошибочных диагнозов и неадекватной терапии у пациенток с дефицитом железа [9]
| Ошибочный диагноз | Частота | Терапия | Доля пациенток с неправильно поставленным диагнозом и назначенной терапией | Продолжительность терапии (медикаментозная /психотерапия, в неделях) | ||
| N; % | N; % | % от общего числа | Коли- чество | 95% ДИ | Мин; Макс. | |
| Депрессия | 113; 11.2 | 71; 62.2 | 7.0 | 104 | 67; 140 | 0; 780 |
| Выгорание | 53; 5.3 | 22; 41.0 | 2.2 | 27 | 5; 50 | 0; 416 |
| Тревожное состояние | 52; 5.2 | 30; 56.5 | 2.9 | 51 | 14; 88 | 0; 780 |
| Хроническая усталость | 71; 7.1 | 20; 27.5 | 1.9 | 54 | 10; 117 | 0; 624 |
| Другие | 65; 6.5 | 31; 47.0 | 3.0 | 34 | 1; 71 | 0; 1560 |
| Итог | 354; 35.3 | 174; 46.8 | 17.0 | – | – | – |
Клинический анализ крови и определение уровня сывороточного ферритина – обязательный, хоть и не всегда достаточный «минимум» в диагностике железодефицитных состояний [10]. Согласно клиническим рекомендациями, для диагностики ЖДА обязательными являются выполнение общего анализа крови, оценка гематокрита, исследование уровней эритроцитов и ретикулоцитов в крови с определением среднего содержания и средней концентрации гемоглобина в эритроцитах, а также определение размеров эритроцитов у пациентов с анемическим синдромом. При этом современные гематологические анализаторы позволяют оценивать дополнительные параметры, являющиеся высокочувствительными индикаторами железодефицитного эритропоэза, например, Ret-He, отражающий содержание гемоглобина в ретикулоцитах, и HYPO-He, отражающий процент гипохромных эритроцитов. В отличие от традиционных биохимических маркеров метаболизма железа, Ret-He и HYPO-He не зависят от воспалительных процессов, уремии и беременности. Снижение Ret-He менее 30.6 пг отражает недостаточную доступность железа для эритропоэза раньше, чем это проявляется изменением среднего содержания гемоглобина в эритроците, MCH. Ret-He на фоне ферротерапии является ранним маркером эффективности лечения, предшествуя развитию ретикулоцитарного криза и повышению уровня гемоглобина. Увеличение HYPO-He более 5% свидетельствует о наличии дефицита железа (как при ЖДА, так и при ЛЖД) и может служить альтернативой определению ферритина.
Оценка эритроцитарных индексов позволяет получить ценную информацию о состоянии эритропоэза и составляет основу диагностики ЛДЖ и ЖДА. Средний объем эритроцита, MCV, измеряемый в фемтолитрах (фЛ, 10⁻¹⁵/л), рассчитывается как отношение гематокрита к количеству эритроцитов. Этот показатель определяется автоматически анализатором путем оценки многих тысяч эритроцитов. При наличии значительного количества аномальных эритроцитов, например при серповидно-клеточной анемии, определение MCV становится менее достоверным. Основой для дифференциальной диагностики анемий служит среднее содержание гемоглобина в эритроците, MCH), измеряемое в пикограммах (пг, 10⁻¹² г) на клетку. MCH представляет собой отношение уровня гемоглобина к количеству эритроцитов. Он соответствует цветному показателю, который использовался ранее для отражения содержания гемоглобина в эритроцитах. Средняя концентрация гемоглобина в эритроцитах, MCHC, отражает степень насыщения эритроцита гемоглобином и является наиболее чувствительным показателем при нарушениях образования гемоглобина. Он рассчитывается как отношение общего гемоглобина к гематокриту (т.е. объему, который занимают эритроциты в кровяном русле) и измеряется в граммах на литр. Это один из самых стабильных гематологических показателей, который используется как индикатор ошибок анализатора. В отличие от MCH, MCHC характеризует не абсолютное количество гемоглобина, а плотность его распределения в клетке. В качестве дополнительного маркера железодефицита рекомендуется оценивать распределение эритроцитов по объему, RDW. Этот показательно позволяет количественно оценивать степень анизоцитоза. Существуют разные варианты подсчета RDW. RDW-CV (в процентах) показывает относительное отклонение объема эритроцитов от среднего значения, а RDW-SD (в фемтолитрах) отражает абсолютную разницу между самым маленьким и самым большим эритроцитом. Поскольку определение RDW проводится автоматически, он обеспечивает более точную оценку анизоцитоза по сравнению с традиционной микроскопией мазка крови [10].
Снижение запасов железа в депо – ключевой маркер клинически значимого железодефицита. И хотя на ЛДЖ приходится до 80% всех железодефицитных состояний, диагностировать его часто сложнее, чем ЖДА, из-за отсутствия изменений уровня гемоглобина – характерного признака ЖДА (Таблица 2). Согласно ВОЗ, легкая ЖДА устанавливается при уровне гемоглобина 90-120 г/л, умеренная и тяжелая – при уровнях 90-70 г/л и менее 70 г/л, соответственно (Таблица 2 – Таблица 4).
Таблица 2. Нормы гемоглобина по данным разных источников
| Женщины | Мужчины | |
| Общепринятые нормы | 120-165 | 135-170 |
| ВОЗ | 120-165 | 130-170 |
| Клиника Майо | 116-150 | 132-166 |
| Клиника Клинвленда | 123-153 | 140-175 |
| Медскейп | 120-160 | 140-180 |
| Клиника Бристоль | 120-150 | 130-170 |
| Институт Рочестер | 116-122 | 132-142 |
| Американское общество гематологов | 120-160 | 140-174 |
Таблица 3. Норма гемоглобина у беременных [11]
| Гемоглобин, г/л | Гематокрит, % | |
| Мужчины | ||
| Небеременные женщины | ||
| 1 триместр | ||
| 2 триместр | ||
| 3 триместр | ||
| Послеродовый период |
Таблица 4. Клинический анализ крови: гематокрит, эритроциты, гемоглобин [12]
| Небеременные | 1 триместр | 2 триместр | 3 триместр | |
| Гематокрит (%) | 35.4-44.4 | 33.0-41.0 | 32.0-39.0 | 30.0-40.0 |
| Эритроциты (x106/мм3) | 4.00-5.20 | 3.42-4.55 | 2.81-4.49 | 2.71-4.43 |
| Гемоглобин (г/л) | 120-158 | 111-139 | 106-148 | 95-150 |
Характерным лабораторным признаком ЖДА является развитие микроцитарной гипохромной анемии, что находит отражение в изменениях эритроцитарных индексов. Снижение MCV и MCH свидетельствует о уменьшении размера эритроцитов и недостаточном содержании в них гемоглобина, а повышение RDW отражает усиление неоднородности клеточной популяции вследствие нарушенного эритропоэза. Эти изменения развиваются постепенно, причем на ранних стадиях ЛЖД, когда уровень гемоглобина еще остается в пределах нормы, уже могут наблюдаться начальные сдвиги в эритроцитарных индексах, что делает их ценным инструментом для ранней диагностики железодефицитных состояний (Таблица 5).
Таблица 5. Эритроцитарные индексы
| Ширина распределения эритроцитов (анизоцитоз эритроцитов) | Red cell distribution of width RDW | % | 11.5-14.5 >14.5% – анизоцитоз |
| Средний объем одного эритроцита | Mean Cell Volume MCV = Hct/ Эритроциты | фЛ (фемтолитр) | 80-100 >100 фЛ – макроцитоз |
| Среднее содержание гемоглобина в эритроците (почти цветовой показатель) | Mean cell hemoglobin MCH = Hb/Эритроциты | пг (пикограмм) | 27-33 >33 пг – гиперхромия |
| Средняя концентрация гемоглобина в эритроците (плотность накопления гемоглобина) | Mean cell hemoglobin concentration MCHC = Hb/Hct | г/л | 330-370 >330 г/л – гиперхромия |
*В последние годы произошло переосмысление референсных значений MCV. Согласно актуальным данным, микроцитарная анемия диагностируется при значениях MCV 92 фЛ свидетельствуют о макроцитарной анемии.
Интерпретация эритроцитарных индексов у беременных должна проводиться с особой осторожностью, поскольку они могут оставаться в пределах нормы даже при наличии анемии. Например, характерный микроцитоз развивается только у 75% пациенток, тогда как у каждой третьей беременной с ЖДА он отсутствует. В этом контексте сывороточный ферритин остается наиболее чувствительным и специфичным маркером дефицита железа: низкий уровень ферритина всегда указывает на дефицит железа, независимо от других показателей. Согласно клиническим рекомендациям [10], референсные значения ферритина в общей популяции составляют 11.0-306.8 нг/мл. Однако современные диагностические алгоритмы чаще ориентируются на пороговые значения: уровень ферритина сыворотки ниже 30 нг/мл (мкг/л) свидетельствует об истощении запасов железа, а показатель ниже 45 нг/мл (по данным Американского общества гастроэнтерологов) подтверждает диагноз ЖДА.
В связи с широкой вариативностью нормативных показателей, для беременных женщин установлены особые критерии оценки ферритина. Оптимальный уровень сывороточного ферритина на этапе прегравидарной подготовки должен составлять не менее 70 нг/мл (мкг/л). Это требование обусловлено значительным увеличением потребности в железе во время беременности и важностью профилактики осложнений, связанных с его дефицитом [13–17]. Терапевтические подходы при ЛДЖ и ЖДА у беременных зависят от срока беременности и степени тяжести анемии. При ЛДЖ (уровень ферритина
И хотя сывороточный ферритин остается «золотым стандартом» в диагностике железодефицитных состояний, его интерпретация требует учета клинического контекста. При синдроме беспокойных ног (болезни Уиллиса-Экбома) уровень ферритина ниже 75 нг/мл (мкг/л) может указывать на связь симптомов с дефицитом железа. При хронических заболеваниях почек и сердечно-сосудистой патологии уровень ферритина может повышаться до 100–120 нг/мл (мкг/л). Независимо от этиологии железодефицита, отмена препаратов железа возможна только при достижении достаточного уровня ферритина сыворотки, подтверждающего восстановление депо [10].
У пациентов, которые обращаются с жалобами на позывы пошевелить ногами, находясь в стационарном положении (т.е. лежа или сидя), следует провести диагностику синдрома беспокойных ног. Диагноз ставится на основании анамнеза и не требует дополнительных анализов, в том числе полисомнографии, за исключением оценки статуса железа – даже у женщин, не страдающих анемией, чтобы определить необходимость назначения заместительной терапии железом. Для того, чтобы заподозрить синдром беспокойных ног, достаточно задать пациенту один вопрос: «Вас беспокоят ноги, когда Вы сидите или лежите?». Он инициирует целенаправленный диалог, который позволяет врачу оценить каждый из основных критериев (10 критериев по шкале тяжести синдрома беспокойных ног) и исключить имитирующие состояния (например, ночные судороги ног во время беременности). Тяжесть симптомов и их влияние на функционирование должны быть задокументированы, поскольку они определяют потребность в лечении, выходящем за рамки уверенности и возможных нефармакологических вмешательств [18,19].
Сывороточный ферритин не всегда отражает истинные запасы железа в организме. Его уровень может повышаться при воспалении, параллельно с уровнем С-реактивного белка, в связи с чем одновременное назначение этих анализов нецелесообразно, а определение ферритина ранее чем через 4 недели после перенесенного инфекционного или воспалительного заболевания может дать ложные результаты. Помимо воспаления, повышенный уровень ферритина может быть связан с другими физиологическими и патофизиологическими состояниями, включая беременность, инфекционные и хронические воспалительные (сахарный диабет, аутоиммунные патологии, ожирение) и онкологические заболевания, наследственные нарушения (гемохроматоз, гемолитические анемии), а также избыточное поступление железа (внутривенные инфузии, гемотрансфузии). Неспецифическое повышение уровня ферритина может наблюдаться с возрастом (после 40 лет) и на фоне приема кортикостероидов. При этом в клинической практике отсутствует единое мнение о пороговом значении «высокого ферритина»: чаще за верхнюю границу нормы принимают 400 мкг/л для обоих полов; уровень выше 1000 мкг/л требует углубленного обследования.
Сывороточное железо, общая железосвязывающая способность (ОЖСС) и трансферрин, не являются объективными маркерами запасов железа в депо. Коэффициент насыщения трансферрина железом (КНТ) – более надежный показатель, который не зависит от воспаления:
КНТ (%) = (сывороточное железо / ОЖСС) × 100,
где ОЖСС = трансферрин (г/л) × 1 389
Значение КНТ ниже 20% свидетельствует о дефиците железа независимо от уровня ферритина [20].
Современные принципы фармакотерапии железодефицитных состояний
Даже ранний дефицит железа, протекая бессимптомно, может запускать нарушения молекулярных и биохимических процессов в клетках. В организме железо входит в состав многочисленных белков, участвующих в репликации ДНК, клеточном дыхании, образовании АТФ, работе нервной и мышечной систем. Наиболее значимые из них –гемопротеины (гемоглобин, миоглобин, цитохромы, цитохромоксидаза, гомогентизиноксидаза, пероксидаза, миелопероксидаза, каталаза), железофлавопротеины (цитохром-С-редуктаза, сукцинатдегидрогеназа, пролиноксидаза, НАДФ-дегидрогеназа, ацил-КоА-дегидрогеназа, ксантинооксидаза, металлопротеидов др.) и другие железосодержащие белки разных молекулярных конфигураций (трансферрин, ферритин, гемосидерин, мобилферрин, лактоферрин и др.).
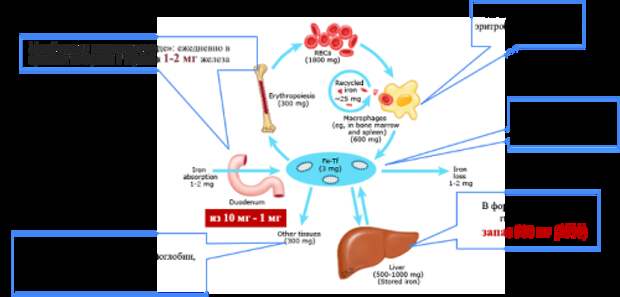
Поскольку дефицит железа несет риск прогрессирующего ухудшения состояния и развития органной ишемии, препараты железа назначаются как при ЖДА, так и при ЛЖД даже при отсутствии клинических симптомов. Интересно, что при нормальном уровне гемоглобина может наблюдаться значительное снижение ферритина, что объясняется особенностями метаболизма железа. Транспортная форма железа, связанная с трансферрином в плазме, составляет всего 3-4 мг, однако именно эта фракция играет центральную роль в поддержании железного гомеостаза. Основная его часть (2.0-2.5 г) находится в гемоглобине эритроцитов и эритробластах, тогда как запасы в форме ферритина составляют лишь 300-400 мг Остальное железо депонируется в виде ферритина и гемосидерина. У мужчин запасы железа достигают примерно 1 г (преимущественно в печени, селезенке и костном мозге). У женщин же они значительно меньше, что обусловлено физиологическими кровопотерями при менструациях, беременностях и лактации. Ежедневно организм полностью метаболизирует около 1-2 мг железа, при этом основная часть реутилизируется макрофагами ретикулоэндотелиальной системы при разрушении старых эритроцитов. Практически все циркулирующее железо связано с трансферрином, что не только обеспечивает его растворимость, но и предотвращает токсическое действие свободных ионов железа, способных индуцировать окислительный стресс (Рис. 1).
Рисунок 1. Регуляция абсорбции, транспорта и гомеостаза железа.
Клинические проявления железодефицита зависят от скорости и степени снижения гемоглобина. При ЛЖД рекомендуется назначать не менее 60 мг железа в сутки, при ЖДА – не более 120 мг/сут. БАДы с минимальным содержанием железа (сукросомальное, микросомальное, хелатное железо) могут использоваться только для профилактики, тогда как лечение требует обязательного применения лекарственных препаратов [10].
Целью лечения ЖДА является введение железа в количестве, необходимом для нормализации уровня гемоглобина (у женщин 120-140 г/л, у мужчин 130-160 г/л) и восполнения тканевых запасов железа (ферритин сыворотки> 40-60 мкг/л).
Целью лечения латентного дефицита железа является нормализация концентрации тканевых запасов железа (повышение ферритина более 40-60 нг/мл) и регресс проявлений сидеропенического синдрома.
Клинические рекомендации МЗ РФ «Железодефицитная анемия» 2024 [10].
Пероральные препараты двухвалентного железа являются первой линией терапии железодефицитных состояний. Выбор конкретной лекарственной формы зависит от возраста пациента: соли двухвалентного железа чаще назначаются взрослым, тогда как трехвалентные соединения чаще используются в педиатрической и гериатрической практике. Парентеральное введение показано при неэффективности или непереносимости пероральных форм, мальабсорбции, пациентам с расстройствами всасывания вследствие предшествующей обширной резекции кишечника (гастрэктомия или бариатрическая хирургия), при воспалительных заболеваниях кишечника (язвенный колит, болезнь Крона), на в преддиализном и диализном периодах хронической болезни почек, при хронической сердечной недостаточности, а также при необходимости быстрой коррекции железодефицита (предстоящая операция, ЖДА во II и ЛЖД в III триместре беременности) и при тяжелой ЖДА. Внутривенное железо противопоказано в I триместре беременности.
Диета, хоть и не может рассматриваться в качестве самостоятельного терапевтического средства, имеет критическое значение при лечении железодефицита. Пациентам, принимающим препараты железа, следует избегать одновременного приема с антацидами, ингибиторами протонной помпы, антибиотиками, левотироксином, препаратами кальция и магния, поливитаминами, а также с продуктами, содержащими фитаты (отруби, овес, ржаная клетчатка, цельные зерна), фосфаты, полифенолы (чай, кофе, красное вино, некоторые овощи и злаки), кальций (молочные продукты) и соевый белок.
Биодоступность пищевого железа широко варьирует: гемовое железо из животных продуктов усваивается на 30%, негемовое железо из растительной пищи – лишь на 10%. Аскорбиновая кислота улучшает всасывание железа как из пищевых источников, так и из лекарственных препаратов. Например, добавление аскорбиновой кислоты к сульфату железа (Сорбифер Дурулес, 100 мг сульфата железа + 60 мг аскорбиновой кислоты) повышает всасываемость железа до 30-40%. Препараты железа принимают утром натощак, запивая полным стаканом воды (1 таблетка Сорбифер Дурулес 1 раз в день). Продолжительность терапии варьирует от 8-12 недель до 5-6 месяцев в зависимости от степени железодефицита. Для восполнения депо в печени прием препаратов железа необходимо продолжать не менее 8 недель после нормализации уровня гемоглобина. Пациенткам с ЛДЖ рекомендуется прием препаратов железа через день в течение 3 месяцев с последующим контролем общего анализа крови и ферритина.
«Красные флаги» аномальных маточных кровотечений:
- Кровотечение длится более 7 дней.
- Кровотечение заполняет один или более тампонов/прокладок каждый час в течение нескольких часов подряд.
- Необходимо использовать одновременно более одной прокладки для контроля кровотечения.
- Необходимо менять тампоны/прокладки в течение ночи.
- Менструальное кровотечение со сгустками размером 2-3 см и более.
Графическая оценка величины менструальной кровопотери (Pictorial Bleeding Assessment Chart; чувствительность 58-99%, специфичность 75-89%) позволяет объективизировать диагноз: для подтверждения тяжелого менструального кровотечения необходимо набрать 100 и более баллов (соответствует ≥80 мл кровопотери в сутки). Рецидивы железодефицита могут быть связаны с обильными менструациями, инфекцией Helicobacter pylori, аутоиммунным гастритом или целиакией. При отсутствии эффекта от терапии необходимо проанализировать комплаентность пациента, технику приема препарата, наличие сопутствующих заболеваний и продолжающихся потерь железа.
Основу патогенеза анемий составляют три типа нарушений эритропоэза: дефекты пролиферации, созревания (включая дефицитные формы) или выживания эритроцитов. И хотя ЖДА действительно преобладает в структуре анемического синдрома, составляя до 80% случаев у взрослых, преимущественно женщин репродуктивного возраста, и 90% у детей, анемия – это гетерогенная группа состояний, не ограничивающаяся железодефицитом. Гемоделюционная анемия, обусловленная снижением концентрации гемоглобина и гематокрита из-за увеличения объема плазмы, часто встречается среди беременных, а фолиеводефицитная анемия нередко является маркером имеющейся В12-дефицитной анемии. Диагностические критерии латентного дефицита витамина В12 также были пересмотрены в последние годы. Современные нормативные значения составляют выше 488 пг/мл (360 пмоль/л), уровень ниже 200 пг/мл (148 пмоль/л) говорит об абсолютном дефиците. Для повышения диагностической точности рекомендуется дополнительная оценка промежуточных метаболитов – метилмалоновой кислоты и гомоцистеина. Наиболее сложной для диагностики остается анемия хронических заболеваний, которая «маскируется» проявлениями основной органической патологии. Реже встречаются наследственные гемолитические анемии (талассемия и серповидноклеточная анемия) и приобретенные гемолитические формы (Таблица 6).
Таблица 6. Причины анемии у взрослых
| Размер RBC/MCV | Количество ретикулоцитов | |
| Низкое или нормальное* | Увеличилось | |
| Микроцитарный MCV менее 80 (85) фЛ | • Дефицит железа (поздний) • Анемия хронического заболевания/воспаления • Сидеробластные анемии | • Талассемия • Гемолиз |
| Нормоцитарный MCV от 80 до 100 фЛ (85-92 фЛ) | • Кровотечение (острое) • Дефицит железа (ранний) • Анемия хронического заболевания/воспаления • Подавление костного мозга (рак, апластическая анемия, инфекция) • Хроническая почечная недостаточность • Гипотиреоз • Гипопитуитаризм • Избыток алкоголя • Дефицит меди/отравление цинком | • Кровотечение (с восстановлением костного мозга) • Гемолиз • Восстановление костного мозга (например, после инфекции, замены витамина В12 или фолиевой кислоты и/или замены железа) |
| Макроцитарный MCV >100 фЛ (92 фЛ) | • Дефицит витамина В12 или фолиевой кислоты • Избыток алкоголя • Миелодиспластический синдром • Заболевания печени • Гипотиреоз • ВИЧ-инфекция • Лекарства, которые препятствуют ядерному созреванию (гидроксимочевина, метотрексат, некоторые химиотерапевтические средства) | • Гемолиз • Восстановление костного мозга (например, после инфекции, замены витамина В12 или фолиевой кислоты и/или замены железа) |
Талассемия как «типичный» представитель наследственных анемий характеризуется стойким снижением уровня гемоглобина и выраженным микроцитозом (низкими эритроцитарными индексами) при повышенном количестве эритроцитов, нормальным уровнем тромбоцитов и лейкоцитов, а также компенсаторным повышением ретикулоцитов, отражающим гиперпролиферативный характер анемии. При этом уровень сывороточного ферритина обычно остается в пределах нормы или незначительно снижен. Для диагностики талассемии используется индекс Менцера (MCV/количество эритроцитов; талассемия устанавливается при значении
Заключение
Дефицит железа можно с уверенностью назвать глобальной проблемой. Каждый третий житель планеты и каждый пятый житель России имеет скрытый железодефицит. Среди беременных распространенность железодефицита увеличивается вдвое, достигая в среднем 40% и 75% к третьему триместру. Эта неутешительная статистика еще раз подчеркивает фундаментальное значение своевременной диагностики и коррекции железодефицита в рамках холистического подхода, учитывающего сложность клинической картины и патофизиологических механизмов, прочно «связывающих» анемию с другими соматическими заболеваниями.
Список литературы
- Pasricha SR. Should we screen for iron deficiency anaemia? A review of the evidence and recent recommendations. Pathology. 2012;44(2):139-147.
- Yang J, Chang Q, Du Q, Liu X, Dang S, Tian X. Maternal iron nutrition during pregnancy and fetal intrauterine growth. Nutr J. 2024;23(1):140.
- Guo L, Yin S, Wei H, Peng J. No evidence of genetic causation between iron and infertility: a Mendelian randomization study. Front Nutr. 2024;11:1390618. Published 2024.
- Zhang FL, Yuan S, Dong PY, et al. Multi-omics analysis reveals that iron deficiency impairs spermatogenesis by gut-hormone synthesis axis. Ecotoxicol Environ Saf. 2022;248:114344.
- Tonai S, Kawabata A, Nakanishi T, et al. Iron deficiency induces female infertile in order to failure of follicular development in mice. J Reprod Dev. 2020;66(5):475-483.
- Tulenheimo-Silfvast A, Ruokolainen-Pursiainen L, Simberg N. Association between iron deficiency and fertility. Acta Obstet Gynecol Scand. 2025;104(4):738-745.
- Galaris D, Barbouti A, Pantopoulos K. Iron homeostasis and oxidative stress: An intimate relationship. Biochim Biophys Acta Mol Cell Res. 2019;1866(12):118535.
- Li X, Duan X, Tan D, Zhang B, Xu A, Qiu N, Chen Z. Iron deficiency and overload in men and woman of reproductive age, and pregnant women. Reprod Toxicol. 2023;118:108381.
- Blank PR, Tomonaga Y, Szucs TD, Schwenkglenks M. Economic burden of symptomatic iron deficiency — a survey among Swiss women. BMC Womens Health. 2019;19(1):39.
- Клинические рекомендации МЗ РФ, 2024 «Железодефицитная анемия».
- Критерии ВОЗ по диагностике анемии.
- Maternal adaptations to pregnancy: Hematologic changes, UpToDate, 2024.
- Bothwell TH. Iron requirements in pregnancy and strategies to meet them. Am J Clin Nutr 2000; 72:257S.
- WHO recommendations on antenatal care for a positive pregnancy experience. World Health Organization; Luxembourg, 2016.
- Pavord S, Daru J, Prasannan N, et al. UK guidelines on the management of iron deficiency in pregnancy. Br J Haematol 2020; 188:819.
- Anemia in Pregnancy: ACOG Practice Bulletin, Number 233. Obstet Gynecol 2021; 138:e55. Reaffirmed 2024.
- Michael Auerbach, Helain J Landy et all. Anemia in pregnancy, UpToDate, 2024.
- Vahdat M, Sariri E, Miri S et al. Prevalence and associated features of restless legs syndrome in a population of Iranian women during pregnancy. Int J Gynaecol Obstet. 2013 Oct;123(1):46-9.
- Chen SJ, Shi L, Bao YP, Sun YK, Lin X, Que JY, Vitiello MV, Zhou YX, Wang YQ, Lu L. Prevalence of restless legs syndrome during pregnancy: A systematic review and meta-analysis. Sleep Med Rev. 2018;40:43-54.
- Plays M, Müller S, Rodriguez R. Chemistry and biology of ferritin. Metallomics. 2021;13(5): mfab021.
Свежие комментарии